
期刊简介
本刊1988年创刊,中英文混编,原为季刊,1996年改为双月刊,国内外公开发行。本刊由中国航天员科研训练中心主办,主要报道国内外航空航天医学、生物医学工程、以及有关人-机-环境系统工程研究的新理论、新成果、新技术以及新动向。期刊设置有学术论著、文献综述、研究快报等栏目,本刊是我国载人航天及生命科学领域的核心期刊之一,目前被美国工程索引(EI)、医学文献联机检索系统(Medline)、美国剑桥科学文摘(CSA)、美国航空航天数据库、中国科技论文统计分析和引文统计源期刊、中国科技论文数据库(CSCD)、中国学术期刊网(CJN)、万方数据网、中国生物医学文献数据库(CBN)、中国科学工程期刊文摘数据库(英文版)、中国生物医学期刊文献数据库(CMCC)、中国航空航天文献数据库等权威数据库收录,是相关领域广大硕博士毕业生和科研工作人员发表英文论文和中文论文的大舞台。请将电子档投至信箱suhongyu@vip.sina.com,同时要求邮寄纸质稿件1份,单位介绍信1份(证明无失泄密、无政治问题、无一稿多投、作者署名无争议,在校生还需导师签字)、作者简介1份(必须有电子邮箱和联系电话)。
Nature:复杂组织可以被安全的重新编程到更年轻的状态,成功逆转青光眼引起的视力损失
时间:2024-12-03 15:26:40
自古以来,皇帝们为了“万岁万岁万万岁”而劳民伤财、孜孜不倦、日复一日地铸造“长生不老丹”,投入了大量的“科研经费”。
可时至今日,也未见可长生不老的法子。
然而,近日Nature发表了哈佛医学院David Sinclair团队的一项研究成果:发现复杂组织可以被安全的重新编程到更年轻的状态,成功逆转青光眼引起的视力损失。
该研究证明了老化或损伤的器官可以重新焕发年轻活力,待人体各组织的老化被攻克,“长生不老”也许指日可待了。
复杂组织可以被安全的重新编程到更年轻的状态,成功逆转青光眼引起的视力损失" 复杂组织可以被安全的重新编程到更年轻的状态,成功逆转青光眼引起的视力损失
研究背景
衰老是导致组织功能障碍和死亡的退化过程。衰老的一个可能原因是表观遗传改变的积累破坏了基因表达模式,导致组织功能和再生能力下降。随着时间的推移,DNA甲基化模式的改变形成了“衰老时钟”的基础,但是老年人是否保留了恢复这些模式所需的信息尚不清楚。如果保留了,是否能改善组织功能也不清楚。
在细胞培养中,四种Yamanaka转录因子OCT4,SOX2,KLF4和MYC(OSKM)的异位表达可以将培养的体细胞重新编程为多能干细胞,这一过程可消除细胞身份并重置DNA甲基化。另外,这四种因子在小鼠体内的持续表达,往往会诱发畸胎瘤或导致小鼠在几天内死亡。显然,消除细胞身份、导致畸胎瘤(死亡)都不是科学家为了使老化的器官恢复年轻化所想要的。
研究内容与结果
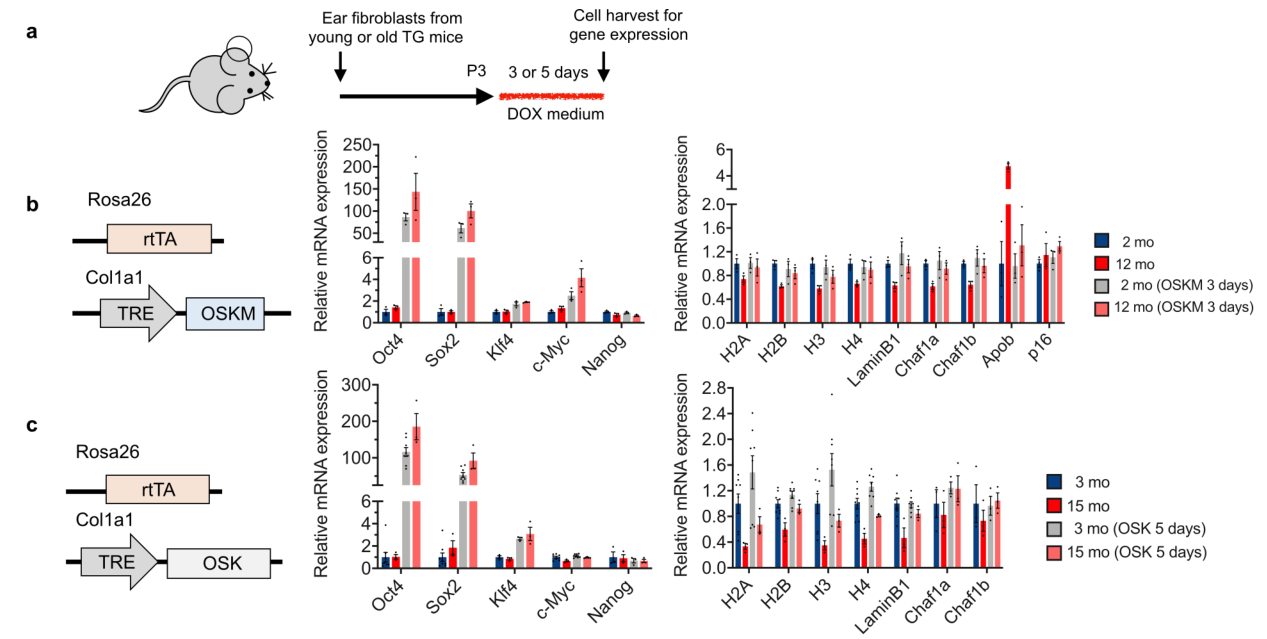
研究人员的第一个目标是找到一种方法,在不消除细胞身份的情况下重置表观基因组。先前研究报道,MYC基因的表达与小鼠寿命缩短有关,而且没有细胞重编程也照样能启动。
因此,研究从Yamanaka因子中剔除MYC,只保留了OCT4、SOX2和KLF4,并命名这个新组合为OSK。
实验结果表明,在小鼠成纤维细胞中,OSK表达5天后促使mRNA谱变的年轻化,而不会明显丧失细胞特性或诱导NANOG(一种指示多潜能和致癌性的转录因子)。
随后研究人员设计了一个双腺相关病毒(AAV)系统,在一个四环素反应元件(TRE)启动子的严格控制下在小鼠中传递和控制OSK的表达。在OSK连续诱导10-18个月后,没有观察到肿瘤发病率的增加或对整体健康的负面影响,表明表达OSK的细胞保持了细胞特性,证明了OSK在体内的长期安全性。
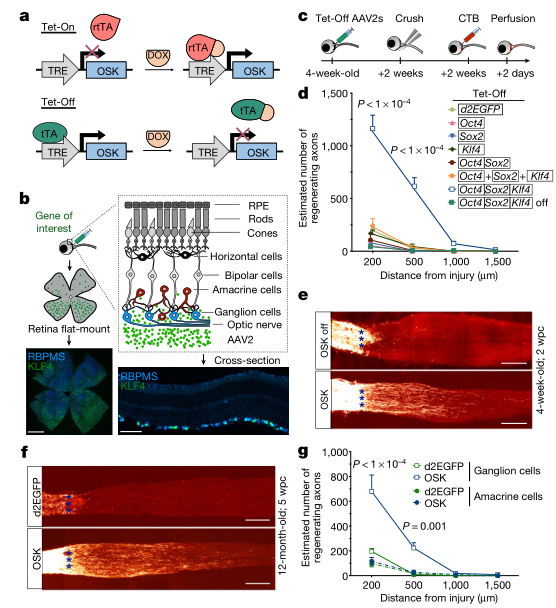
在哺乳动物中,第一个失去再生能力的系统是中枢神经系统。因此研究人员选择了视网膜神经节细胞(RGCs)作为研究对象。视网膜神经节细胞(RGCs)的中枢神经系统投射轴突远离视网膜形成视神经。目前还没有治疗方法可以恢复晚期青光眼或老年人的视力。
为了检验OSK是否能让视网膜神经节细胞恢复初的再生能力,研究人员在视神经撞击模型中诱导了OSK的表达。
实验结果表明,即使在连续诱导15个月后,OSK的表达也没有引起视网膜的任何肿瘤或结构改变。在12个月大的小鼠中,OSK治疗使RGC的存活加倍,类似于在1个月和3个月大的小鼠中观察到的结果。虽然大鼠的轴突再生稍弱,但当治疗延长3周后,轴突再生仍然强劲。这些数据表明,衰老并不会大大降低OSK转录因子诱导轴突再生的能力。OSK诱导的时间越长,轴突延长的距离越大。
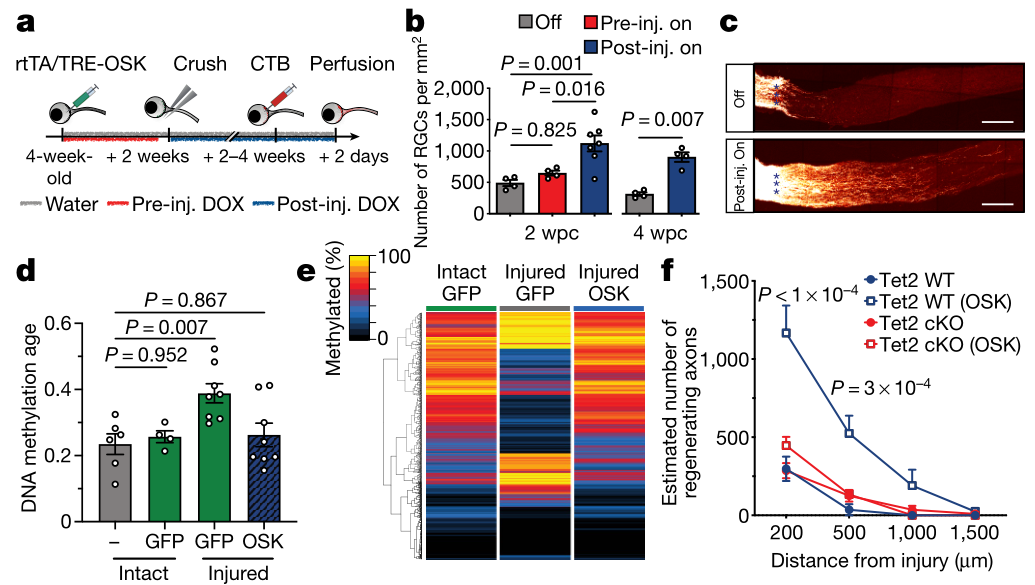
考虑到OSK在损伤后诱导的效果以及Yamanaka因子在体外逆转DNA甲基化年龄的能力,研究人员推测OSK可能通过拮抗损伤对DNA甲基化的影响而对轴突再生起作用。随后的实验发现,在损伤后第4天,RGC经历了DNA甲基化年龄的加速,而OSK表达抵消了这种作用。即OSK逆转了损伤引起的DNA甲基化变化。
接下来研究人员试图了解OSK诱导的DNA甲基化变化是否对RGC存活和轴突再生是必要的。因此通过研究去甲基化酶TET1–TET3的作用证明:为了使OSK保护RGCs和恢复轴突, DNA去甲基化的活性是必要的。
后续的实验证明在人神经元中也观察到了OSK表达促进轴突再生。基于此,研究人员青光眼和自然衰老导致的视力下降小鼠模型中开展了相关实验。
结果令人惊喜,在青光眼小鼠模型中,OSK治疗后的小鼠视力显著提高:视网膜神经节细胞轴突密度恢复的与非青光眼相当,光-运动反应试验表明,因眼压升高而丧失的视力有一半得以恢复。
在因自然老化引起的视力下降小鼠模型中,OSK让12月龄小鼠的下降视力得以恢复,但是没有恢复18月龄小鼠的视力,研究人员认为这可能与年龄相关的角膜不透明性增加有关。
总结
也许等不了多久,基于基因疗法或其它手段,通过表观遗传重编程促进组织修复,可以逆转人类与年龄相关的衰退,“长生不老”指日可待!
未来如果能在更多组织器官中复制这一结果,很多与年龄相关的疾病,或许就多一种新的治疗方式。
